
Principi della Termodinamica
Cos’è la termodinamica e quali sono i suoi principi?
Scopriamolo assieme nelle prossime pagine!
La termodinamica studia lo scambio di energia in reazioni chimiche (esotermiche o endotermiche) e i passaggi di stato.
PRIMO PRINCIPIO
L’ENERGIA PUO’ ESSERE CONVERTITA DA UNA FORMA IN UN’ALTRA, MA NON PUO’ ESSERE NE’ CREATA NE’ DISTRUTTA.
ΔEsist= QV+ L
Ne deriva che l’energia dell’universo e’ costante: ΔE= ΔEsist+ ΔEamb = 0
- Se il sistema perde energia l’ambiente l’acquista.
- Per scambiare energia con l’ambiente il sistema deve essere chiuso (non isolato).
- I mezzi con cui il sistema scambia energia con l’ambiente sono calore Q (se c’è ΔT fra sistema e ambiente) e lavoro L (espansione o compressione)
- L’energia di un sistema è l’energia interna (E). Calore e lavoro esistono solo durante lo scambio.
SCAMBIO DI CALORE A VOLUME COSTANTE (ΔV = 0)
Dato che L = PΔV e ΔV = 0 non viene fatto lavoro.
Il primo principio a volume costante diventa:
ΔEsist= Q
Tutta l’energia fornita sotto forma di calore va ad aumentare l’energia interna del sistema. Il calore scambiato a volume costante coincide con la variazione di energia del sistema.
SCAMBIO DI CALORE A PRESSIONE COSTANTE (ΔP = 0)
Dato che L = PΔV ≠ 0, viene compiuto lavoro
Sapendo che L = -PΔV (il segno meno viene messo per convenzione) si ha:
- Espansione se ΔV=V2–V1 > 0. Dunque L= PΔV = -L, cioè il sistema fa lavoro sull’ambiente.
- Compressione se ΔV=V2–V1 < 0. Dunque L=-PΔV = L, cioè l’ambiente fa lavoro sul sistema.
Il primo principio a pressione costante diventa:
ΔEsist = Q-PΔV
Ne deriva che:
Q = ΔE + PΔV = (E2–E1) + P(V2–V1) = (E2+ PV2) –(E1+ PV1)
Ponendo E + PV = H = entalpia si ha:
Q = H2–H1= ΔH = calore scambiato a pressione costante
Il calore scambiato a pressione costante coincide con la variazione di entalpia.
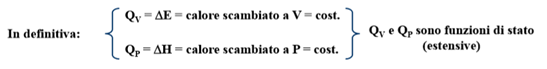
ΔH>0, il sistema assorbe calore (Reazione endodermica)
ΔH<0, il sistema cede calore (Reazione esotermica)
SECONDO PRINCIPIO
LA MATERIA TENDE A DIVENTARE PIU’ DISORDINATA (NEL SISTEMA) E L’ENERGIA TENDE A DISPERDERSI SU UN MAGGIOR NUMERO DI PARTICELLE (NELL’AMBIENTE).
Una trasformazione avviene spontaneamente verso una situazione finale in cui è maggiore il disordine. Lo stato di disordine è il più probabile.
Lo stato iniziale evolve verso lo stato finale solo se la variazione di entropia dell’universo è maggiore di 0
Per capire se un processo è spontaneo bisogna capire se la situazione finale è più probabile della condizione finale.
TERZO PRINCIPIO
Ogni sistema ha un suo contenuto di disordine (detto ENTROPIA)
UN CRISTALLO PERFETTO ALLO ZERO ASSOLUTO HA ENTROPIA S UGUALE A ZERO
Ogni specie chimica ha un’entropia finita e positiva, funzione crescente della temperatura. Aumentando T aumenta l’agitazione termica (moti rotazionali, traslazionali, vibrazionali) quindi aumenta il n° di microstati, aumenta S e il campione si disordina.
I PROCESSI DISORDINANTI sono trasformazioni che portano ad un aumento di entropia del sistema (ΔS sistema> 0)
Esempi di processi disordinanti sono:
- Tutte le trasformazioni in cui le moli di gas aumentano passando da reagenti a prodotti
- I processi di fusione, evaporazione e sublimazione
I PROCESSI ORDINANTI sono trasformazioni che portano ad una diminuzione di entropia del sistema (ΔS sistema < 0)
Esempi di processi ordinanti sono:
- Tutte le trasformazioni in cui le moli di gas diminuiscono passando da reagenti a prodotti.
Questa era la termodinamica;)
Speriamo tu possa aver trovato utile questo nostro articolo.
Se hai domande o commenti non esitare a scrivere qui sotto!

No Comments